Lorsque nous parlons de liaison ionique, nous parlons d'une liaison qui se produit entre des atomes métalliques qui donnent des électrons et des atomes non métalliques qui acceptent des électrons.
D'un autre côté, les atomes non métalliques des familles VIa (groupe 16) et VIIa (groupe 17) ont tendance à accepter des électrons pour former des anions négatifs. Ces anions non métalliques ont une charge négative en raison de l'acquisition d'électrons supplémentaires et sont attirés par les charges positives.
L'attraction électrostatique entre ces ions de signes contraires, le cation positif et l'anion négatif, permet de former la liaison ionique. Cela conduit à la formation de composés ioniques tels que les sels, qui sont des cristaux solides caractérisés par des structures ordonnées où les ions sont étroitement liés par des forces électrostatiques.
Exemple
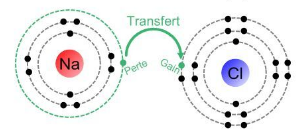
Liaison ionique qui se forme dans le chlorure de sodium (NaCl). Dans cette liaison, l'atome de sodium (Na) de la famille Ia des métaux alcalins a une tendance à perdre un électron de sa couche externe pour atteindre la configuration électronique stable. L'atome de chlore (Cl) de la famille VIIa des halogènes a une tendance à gagner un électron pour atteindre la configuration électronique stable .
Lorsque le sodium perd un électron, il se transforme en un cation Na+ chargé positivement. Lorsque le chlore gagne cet électron, il se transforme en un anion Cl- chargé négativement. Ces ions de charges opposées s'attirent électrostatiquement, formant des liaisons ioniques solides.
En résumé, la liaison ionique résulte de l'attraction électrostatique entre des ions de signes contraires, généralement des cations métalliques et des anions non métalliques, et elle est couramment observée dans les composés ioniques tels que les sels.

.png)


.jpg)




0 Commentaires